Rôle de la pression intra-tendineuse dans les tendinopathies
Publié le : 12 février 2023 à 17h20
Article rédigé par Clément BOUDOT - Kinésithérapeute du sport
La mécanotransduction décrit la capacité d'une cellule à détecter et à convertir des stimulis mécaniques en signaux biochimiques. Ceci permet des modifications intracellulaires et un remodelage de la matrice extracellulaire (MEC) pour s'adapter à l'environnement imposé. Dans les tissus mécaniquement actifs, tels que les tendons, ce processus de mécanotransduction joue un rôle crucial dans la protection des tissus. Il a été démontré que la micro-architecture du tendon s'adapte continuellement aux charges appliquées ou retirées, et que ce processus d'adaptation est dirigé par les ténocytes.
La métaplasie fibrocartilagineuse au niveau de l’enthèse du tendon est une adaptation physiologique afin de mieux résister aux forces compressives imposées à cette zone de jonction os-tendon. On retrouvera donc une augmentation des glycosaminoglycanes (GAG), des protéoglycanes larges (PG), des ténocytes arrondis et élargis ainsi que du collagène de type II pour résister aux forces de compression. Ainsi si les forces de compression sont supérieur qu’à l’accoutumer sur le tendon, cette zone de métaplasie peut s’étendre et dépasser la zone de l’enthèse du tendon. Par conséquent, le tendon tolèrera moins bien les forces de traction.
Ces changements peuvent avoir plusieurs effets négatifs sur le tendon. Premièrement, cette adaptation peut réduire progressivement la rigidité à la traction du tendon, ce qui explique pourquoi la combinaison de traction et de compression est la plus dommageable pour les tendons. Deuxièmement, en raison des fortes propriétés de liaison à l'eau des GAG et des PG chargés négativement, ce remodelage induit également une accumulation de fluide, augmentant la susceptibilité à la compression externe à mesure que l'épaisseur du tendon augmente et rendant la surcharge de compression progressive. Troisièmement, ces changements peuvent également perturber la dynamique de pression intratendineuse.
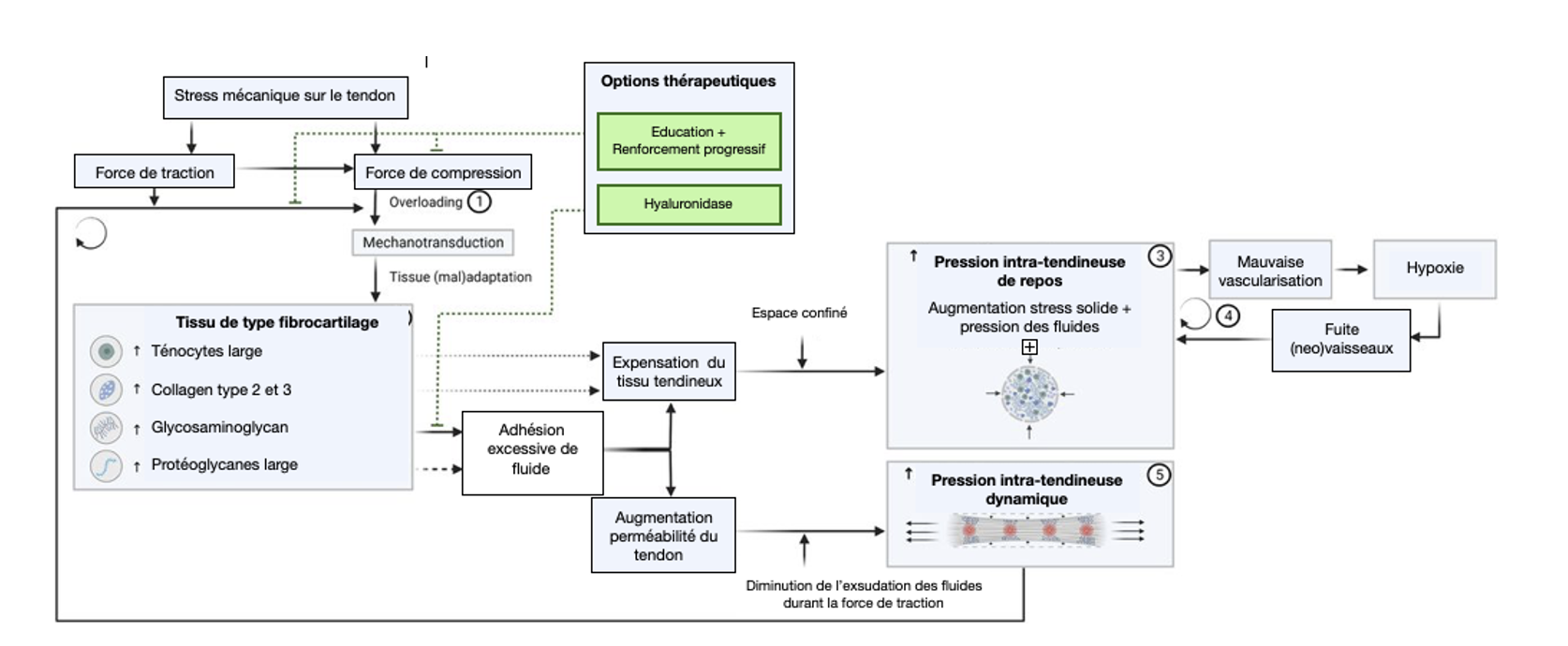
Schéma explicatif du rôle de la pression intratendineuse dans la tendinopathie, adapté de Pringels et al.
Ces arguments indiquent qu'un remodelage excessif du tissu tendineux en un tissu semblable à un fibrocartilage en raison d'une surcharge compressive peut empêcher d'atteindre une homéostasie optimale de la matrice tendineuse et est donc considéré comme potentiellement inadapté. De plus, si la surcharge persiste, le changement de phénotype du tissu peut altérer la réponse des cellules du tendon et entrainer la perte de la structure organisée de la matrice du fibrocartilage, et donc également constituer la première étape d’apparition d’une pathologie du tendon.
L’augmentation du volume et son effet sur la pression de repos intratendineuse
Bien qu'elle soit quelque peu ignorée dans les tendons, chaque structure de notre corps a une pression tissulaire totale (= PTT), qui est la somme de la pression du fluide interstitiel (= PFI) et de la contrainte solide (= CS), qui représente les cellules de notre corps.
Dans la pathologie du tendon, ce phénomène d’augmentation de la PTT semble également plausible. En effet, la prolifération cellulaire et la régulation à la hausse de plusieurs composants de la matrice extracellulaire, en particulier les GAGs et les PGs, avec le liquide qu'elle contient, peuvent induire une forte pression de gonflement.
Il n'est pas encore bien décrit quelle gaine du tendon résisterait principalement à l'expansion du volume, mais l'endotendon et l'épitendon semblent être les responsables. En effet, ils ont une perméabilité assez faible et entourent respectivement les fascicules et le tendon dans son entièreté. L'augmentation de la PTT dans ces espaces confinés, à savoir respectivement intra-fasciculaire ou inter-fasciculaire, peut donc conduire à un "syndrome des loges" dans les tendons, par lequel une pression continue est exercée sur les ténocytes et la MEC associée.
L'augmentation de la pression intratendineuse de repos et vascularisation
Une augmentation de la pression intratendineuse de repos (= PIR) pourrait être un facteur crucial d’une hypoxie intra-tendineuse, car elle nuit à la vascularisation de deux manières. Premièrement, la pression élevée est transmise aux veinules post-capillaires, augmentant la pression veineuse et diminuant ainsi le gradient de pression artério-veineux. En effet, une augmentation de la pression veineuse, indiquant une congestion veineuse, a déjà été trouvée dans la tendinopathie d’Achille corporéales.
Deuxièmement, une augmentation supplémentaire de la PIR pourrait également provoquer la déformation ou l'effondrement des capillaires, réduisant leur rayon et diminuant l'afflux de sang capillaire. Ce phénomène a déjà été décrit dans les neuropathies œdémateuses et cela pourrait expliquer pourquoi des lumières vasculaires rétrécies sont également trouvées dans les tendinopathies dégénératives.
Il convient de mentionner qu'il existe également une relation réciproque entre la pression tissulaire et l'hypoxie. Premièrement, l'hypoxie peut entrainer une vasodilatation artériolaire et une augmentation de la perméabilité vasculaire, permettant à davantage de liquide de pénétrer dans le compartiment affecté.
Deuxièmement, il a déjà été démontré dans les rétinopathies et les tumeurs que les néovaisseaux, qui se forment pendant une hypoxie prolongée, ont généralement une architecture chaotique et perméable. Järvinen et al., ont récemment noté que des fuites peuvent également se produire dans les néovaisseaux que l'on trouve généralement dans les tendinopathies chroniques. Comme cela a été décrit dans les muscles, les nerfs et les tumeurs, les fuites de vaisseaux sanguins augmentent la PIR, créant ainsi un cercle vicieux qui pourrait également se produire dans les tendinopathies.
On aurait donc une augmentation des fluides dans le tendon qui augmenterait la pression intra-tendineuse. Cette augmentation de la pression favoriserait la fuite des vaisseaux sanguins et entrainerait donc une augmentation de fluide sur la zone. Le cercle vicieux est alors créé.
Réduction de la perméabilité et augmentation de la pression dynamique intratendineuse
Environ 70 % du poids des tendons est constitué d'eau. Cependant, la quantité d'eau peut varier en raison de l’entrée et la sortie des fluides. Lors d’une traction, les tendons subissent une contraction latérale (coefficient de Poisson > 0,5), ce qui génère une pression positive du fluide et entraine une exsudation et par conséquent un rétrécissement du volume. Ce phénomène explique en partie la réduction aigüe de l'épaisseur du tendon en réponse à l'exercice, ce qui équivaut à une diminution transversale d'environ 6 %.

Le terme de pression dynamique intratendineuse (= PDI) sert à désigner la quantité de pression interne générée pendant la charge de traction dans les tendons. Bien qu'une analyse directe de la PDI n'ait pas encore été réalisée, une corrélation positive entre la pression du fluide et la déformation passive a déjà été démontrée dans les nerfs et les muscles. Par exemple, la pression intra-neurale dans le nerf sciatique augmente de 8 mm Hg à 56 mm Hg pendant un straight leg raise. Des études théoriques et expérimentales ont également montré que la pression des fluides augmente fortement lorsque la perméabilité hydraulique de la MEC diminue.
Une diminution de la perméabilité transversale se produit généralement dans les pathologies tendineuses en raison de l'augmentation des GAG et des PG retenant l'eau. Le fluide peut donc être piégé à l'intérieur de la matrice du tendon pendant la charge de traction, ce qui se traduit par une PDI nettement plus élevée. En outre, étant donné que le volume de fluide libre est également augmenté dans les pathologies tendineuses, ce qui permet de piéger davantage de fluide, l'effet de pression peut être encore plus prononcé. Cette théorie, exposée par Pringels et al., est cohérente avec les résultats cliniques selon lesquels l'épaisseur du tendon diminue moins après l'exercice chez les patients atteints de tendinopathie. De plus, elles impliquent également que pour une même quantité de charges de traction, les cellules tendineuses subiront davantage de PDI dans les tendons pathologiques que dans les tendons sains, ce qui crée à nouveau un cercle vicieux, et représente un mécanisme plausible pour la progression de la pathologie tendineuse.
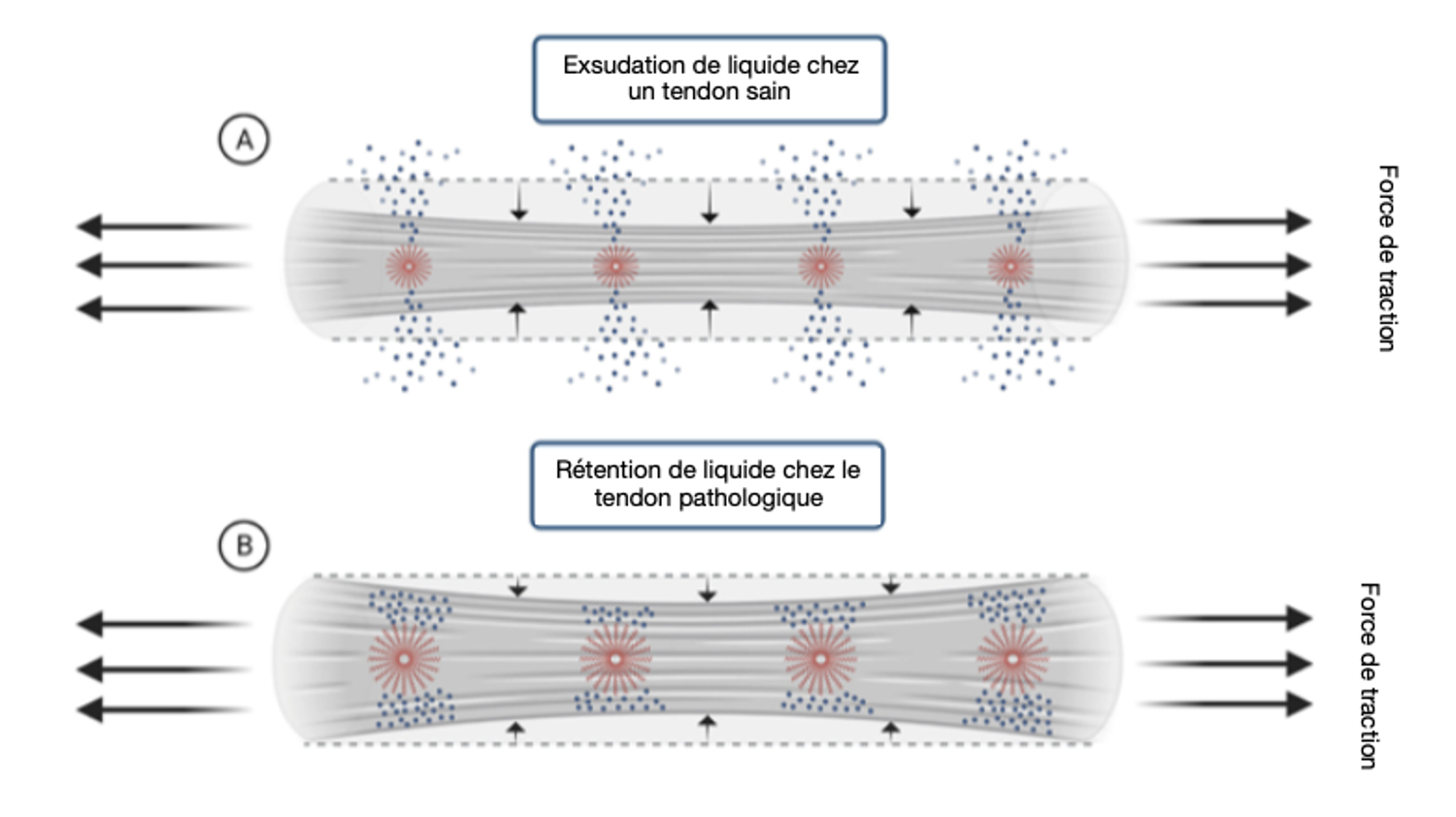
Schéma explicatif de l’augmentation de la pression dynamique intratendineuse lors d’une tendinopathie selon Pringels et al.
Comment ce modèle se rapporte-t-il aux caractéristiques (para)cliniques de la tendinopathie ?
Douleur
En général, le terme "tendinopathie" se réfère à un état pathologique d'un tendon avec une plainte de douleur et une diminution de la fonction. Actuellement, il y a encore beaucoup de questions sur l'identité du moteur nociceptif dans la tendinopathie, car la relation entre la douleur du tendon et la dégradation du tissu n'est pas simple.
Pringels et al., ont supposé qu'une perturbation de l'homéostasie de la pression intratendineuse pourrait être impliquée dans la perception de la douleur. Tout d'abord, une augmentation de la pression intratendineuse peut activer les mécanonocicepteurs situés dans le tissu conjonctif péritendineux (à la fois endo- et épitendon), déclenchant ensuite les fibres Aδ rapides et myélinisées et les fibres C lentes et non myélinisées. Ces fibres sont responsables respectivement de la douleur aigüe et de la douleur « sourde ». Les deux nocicepteurs ont un seuil de pression nocive autour de 100 mm Hg de pression tissulaire, mais leur fréquence de décharge, et donc la sensation de douleur, augmente de manière significative lorsque la pression augmente. Pringels et al., suggèrent que des pressions aussi élevées dans les tendons ne peuvent être atteintes que lors de la mise en charge du tendon et si la perméabilité de la matrice est suffisamment réduite. Ceci est cohérent avec l'observation que la douleur tendineuse est bien corrélée avec l'intensité de la charge et la teneur en GAG ou PG. De plus, puisque la PDI est également corrélée à la vitesse de déformation, cela explique pourquoi les exercices de charge rapide (ex : pliométrie) sont plus provocateurs que les exercices lents (ex : isométrie).
En outre, cela clarifie également l'effet de l'échauffement dans la tendinopathie, puisque l’échauffement du tendon entraine une exsudation contrôlée de liquide, ce qui réduit la PDI.
À l'inverse, cela peut également expliquer la raideur matinale, car la réabsorption et l'accumulation de fluide se produisent généralement la nuit, comme cela a déjà été décrit dans le syndrome du canal carpien. Par conséquent, des PDI vraisemblablement plus élevées se produiront dans un tendon raide et surhydraté lors des premiers pas du matin.
Enfin, deux autres stimuli nocifs qui sont très élevés dans la pathologie des tendons, à savoir le glutamate et le lactate, peuvent également être associés à ce modèle de pression tendineuse décrit par Pringels et al. Le glutamate est généralement libéré par l'activation des fibres C, tandis que le lactate est une conséquence de l'hypoxie prolongée.
Gonflement
Une autre caractéristique clinique de la pathologie tendineuse est le gonflement. Il est principalement attribué à la forte augmentation des GAG et PG hautement chargés négativement qui induisent l'absorption d'eau. Par exemple, dans la tendinopathie rotulienne, la teneur en GAG est multipliée par cinq, accompagnée d'une augmentation du liquide de plus de 16%.
Il y a deux facteurs importants à prendre en compte. Premièrement, d'après les études sur les tumeurs, une augmentation du fluide lié aux GAGs (stress solide) aura un impact beaucoup plus important sur la PIR qu'une augmentation du fluide libre (PFI).
Deuxièmement, l'importance de la pression de gonflement dépendra fortement de l'emplacement de l'accumulation de fluide dans la matrice du tendon. En effet, le compartiment intrinsèque, le fascicule, a un espace de diffusion beaucoup plus petit que le grand compartiment extrinsèque de l'IFM. Par analogie, il a déjà été décrit pour les nerfs qu'une petite augmentation du fluide fasciculaire est associée à une augmentation intense de la pression (jusqu'à 750 mm Hg), alors que la même augmentation du fluide dans la matrice inter-fasciculaire a entrainé une pression nettement plus faible (jusqu'à 60 mm Hg). Bien que les PG et les GAG soient présents à la fois au niveau inter- et intra-fasciculaire, l'accumulation de liquide semble se produire principalement au niveau inter-fasciculaire et, par conséquent, il est peu probable que des pressions de repos extrêmement élevées (> 100 mm Hg) se produisent dans la pathologie du tendon.

Implications thérapeutiques
La recherche de nouvelles thérapies en médecine sportive doit s'appuyer sur les découvertes de la science fondamentale. Ce modèle conceptuel propose un rôle central de la pression intratendineuse accrue dans la pathogenèse de la pathologie tendineuse. Par conséquent, les stratégies qui peuvent restaurer la pression intratendineuse pourraient être pertinentes à considérer comme une stratégie de traitement (supplémentaire). Il semble possible de diminuer cette pression tendineuse de deux manières.
D'une part, la mécanotransduction inadaptée doit être traitée. Cela peut se faire en réduisant la quantité de charges compressive, mais en continuant à exercer des forces de traction suffisantes sur le ténocyte pendant la rééducation pour restaurer son phénotype normal et promouvoir la synthèse correcte de la matrice extracellulaire. Par exemple, dans le cas de la tendinopathie d'Achille d’insertion, il est relativement facile d'y parvenir en réduisant la charge en flexion dorsale. En outre, les exercices de résistance lourds-lents donneraient également de meilleurs résultats que les exercices à grande vitesse, car ceux-ci sont associés à une PDI plus faible.
D'autre part, un traitement médicamenteux qui cible directement le contenu élevé en GAG pourrait également être un outil intéressant. Un traitement potentiel qui a été mentionné récemment pour les tendinopathies est la hyaluronidase humaine recombinante, car elle dégrade l’acide hyaluronique, le sulfate de chondroïtine et le sulfate de dermatane de la MEC pour les ramener à des niveaux pré-lésionnels. L'élimination de ces GAG en excès peut libérer le fluide lié et réduire de manière significative la teneur en fluide, ce qui se traduit par un PIR plus faible, permettant ainsi la ré-expansion vasculaire.
En outre, comme la dégradation enzymatique des GAG augmente également la perméabilité de la matrice, ce qui permet au fluide de s'exsuder plus facilement pendant la charge, cela se traduira également par une PDI plus faible. L'utilisation de la hyaluronidase humaine recombinante peut donc être particulièrement utile dans la phase réactive ou de début de détérioration, avant que des dommages structurels irréparables ne se soient produits. Heureusement, des études expérimentales antérieures ont montré que la déplétion des GAGs dans les fascicules tendineux ne diminue pas la rigidité à la traction. Pringels et al., proposent donc que ce traitement, qui est utilisé dans différentes applications médicales depuis plus de 60 ans, puisse également être sûr pour les tendons.
À lire également :
- La tendinopathie d’Achille : explication et traitement
- Tendons et tendinopathies: description, guérison et traitements
- Tendinopathies : quels sont les traitements les plus efficaces (Excentrique, « Progressive loading », HSR …)
Tout le contenu de cet article est présenté à titre informatif. Il ne remplace en aucun cas l’avis ou la visite d’un professionnel de santé.
Source :
Pringels, L., Cook, J. L., Witvrouw, E., Burssens, A., Vanden Bossche, L., & Wezenbeek, E. (2022). Exploring the role of intratendinous pressure in the pathogenesis of tendon pathology: a narrative review and conceptual framework. British journal of sports medicine, bjsports-2022-106066. Advance online publication. Article sous Creative Commons Attribution Non Commercial license (CC BY-NC 4.0).