Introduction
La polyarthrite rhumatoïde (PR) est définie comme une pathologie auto-immune systémique associée à un processus inflammatoire chronique, qui peut endommager à la fois les articulations et les organes, notamment le cœur, les reins, les poumons, le système digestif, les yeux, la peau et le système nerveux. De nombreux types d'arthrite ont été étudiés et décrits afin de les classer en arthrite non inflammatoire (arthrose) et en arthrite inflammatoire causée par des dépôts de cristaux, par des infections bactériennes et virales ou par des processus auto-immuns.
Anatomie
Crédit : Traduit par NeuroXtrain : Radu, A. F., & Bungau, S. G. (2021). Management of Rheumatoid Arthritis: An Overview. Cells, 10(11), 2857. Article sous Creative Commons Attribution (CC BY) license
Étiologie
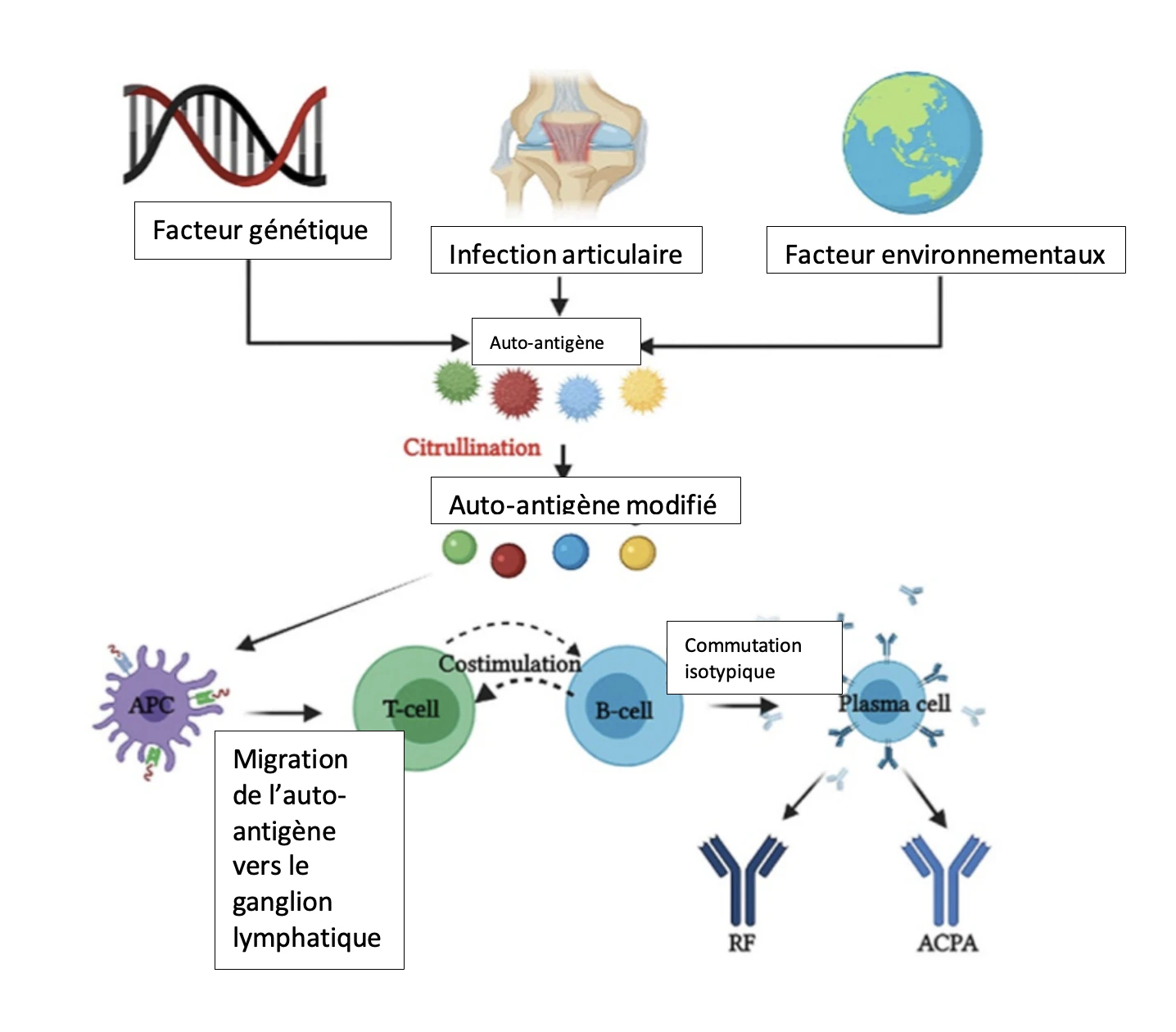
Bien que la cause du déclenchement de la PR soit inconnue, il a été démontré que des facteurs génétiques et environnementaux contribuent au développement de la PR. Comme on le suppose pour d'autres maladies auto-immunes, il est probable que l'établissement initial de la PR nécessite deux événements distincts :
(1) une prédisposition génétique du patient concerné entraînant la génération de lymphocytes T et B autoréactifs, et,
(2) un événement déclencheur, tel qu'une infection virale ou bactérienne ou une lésion tissulaire, fournissant les cellules présentatrices d'antigènes (CPA) pour activer les lymphocytes autoréactifs précédemment générés, ce qui entraîne une rupture de la tolérance et la destruction ultérieure des tissus/organes.
Par conséquent, la PR se développe probablement chez des individus génétiquement prédisposés en raison d'une combinaison de variations génétiques, de modifications épigénétiques et de facteurs environnementaux déclenchés par un événement stochastique (par exemple, une blessure ou une infection).
Dans la PR, la destruction auto-immune des tissus se manifeste par une synovite, une inflammation de la capsule articulaire composée de la membrane synoviale, du liquide synovial et des os correspondants. Cette inflammation articulaire est initiée et entretenue par une interaction complexe entre différents sous-types de cellules dendritiques (CD), les cellules T, les macrophages, les cellules B, les neutrophiles, les fibroblastes et les ostéoclastes. Comme les auto-antigènes spécifiques de la PR, présents de manière ubiquitaire, ne peuvent pas être complètement éliminés, cette activation continue des cellules immunitaires entraîne un état inflammatoire chronique auto-entretenu dans l'articulation et un gonflement de la membrane synoviale qui se manifeste par des douleurs et un gonflement de l'articulation chez les patients atteints. Ce milieu inflammatoire chronique dans l'articulation arthritique entraîne à son tour une expansion de la membrane synoviale appelée « pannus » qui envahit l'os périarticulaire à la jonction cartilage-os, entraînant une érosion osseuse et une dégradation du cartilage.
Épidémiologie
Aujourd'hui, la prévalence mondiale de la PR est d'environ 1 % et elle est plus fréquente chez les femmes, avec de légères fluctuations continues et une croissance apparente du sud vers le nord, et des campagnes vers les zones métropolitaines.
Également, il a été observé qu'il existe des différences entre les sexes en ce qui concerne la prévalence de la PR. Toutes les études ont rapporté une prévalence de la PR 3 à 5 fois plus élevée chez les femmes que chez les hommes.
L'influence de l'âge sur l'incidence de la PR a été évaluée et montre une augmentation de son apparition avec l'âge jusqu'à 80 ans, âge auquel l'incidence commence à diminuer.
Diagnostic et évaluation
Selon les critères 2010 de l'EULAR (Ligue Européenne Contre les Rhumatisme), l'atteinte articulaire est classée de 0 à 5 points en fonction du nombre et de la taille des articulations touchées (nécessitant la présence au moins une articulation cliniquement gonflée). La catégorie des grandes articulations comprend les chevilles, les hanches, les coudes, les épaules et les genoux, tandis que la catégorie des petites articulations comprend les articulations interphalangiennes proximales, les poignets et les deuxièmes à cinquième articulations métatarso-phalangiennes.
Jusqu'à trois points sont attribués en fonction de la présence et de la concentration d'ACPA (= anticorps anti-protéines citrullinées) et d'auto-anticorps anti-facteur rhumatismale (= FR), et un point chacun pour la présence de niveaux anormaux de CRP et l'augmentation de la vitesse de sédimentation des érythrocytes (= ESR) ainsi que la durée globale des symptômes de la maladie.
Cette classification permet d'obtenir un score maximal de 10 points et le diagnostic de PR est posé si le score global du patient est supérieur à six et si d'autres causes de synovite (par exemple, d'autres affections arthritiques inflammatoires, une infection ou un traumatisme) peuvent être exclues. Dans l'ensemble, la sensibilité des critères 2010 de l'EULAR est de 82 % et la spécificité de 61 %.
Critère |
| Points |
Articulation touché(s) | 1 grande 2-10 grande 1-3 petite 4-10 petite >10 (au moins 1 petite) | 0 1 2 3 5 |
Sérologie | FR et ACPA négatif FR et ACPA légèrement positif FR et ACPA très positif | 0 2 3 |
Réactifs de la phase aiguë | CRP et ESR normal CRP et ESR anormal | 0 1 |
Durée des symptômes | < 6 semaines > 6 semaines | 0 1 |
|
| Total = Score |
Facteurs de risques
Le tabagisme, l'obésité, l'exposition aux rayons UV, les hormones sexuelles, les médicaments, les modifications du microbiome de l'intestin, de la bouche et des poumons, les maladies parodontales (parodontite) et les infections sont autant de facteurs de risque pour l'apparition de la polyarthrite rhumatoïde. Également les facteurs environnementaux comme la pollution et les habitudes alimentaires (consommation de café, de viandes rouges excessives…) peuvent influencer l’apparition de la PR. Parmi ces facteurs, le lien entre les maladies parodontales et le développement de la PR est particulièrement intéressant. Il existe également un facteur de risque majeur qui une prédisposition génétique.
Traitement et prévention
La caractérisation des facteurs de risque fournit des outils de prévention de la PR. L'accent mis sur la prévention peut constituer une part importante de la gestion générale de la PR. Quatre niveaux de prévention (primaire, secondaire, tertiaire, clinique) ont été mis en évidence. La prévention primaire vise à empêcher le déclenchement de processus pathologiques, la prévention secondaire identifie les facteurs de risque afin de les réduire, et la prévention tertiaire s'intéresse aux mécanismes de limitation des dommages. La prévention clinique comprend la réduction des complications et l'arrêt/diminution des rechutes. Les stratégies de dépistage des personnes à risque de développer une PR peuvent permettre de réduire les taux d'incidence et de prévalence.

Les approches non pharmacologiques ont pour but de réduire l'anxiété et la dépression, de diminuer la douleur et d'accroître la mobilité.
Une des recommandations pour la prise en charge non pharmacologique par le Collège Américain de rhumatologie concerne la pratique régulière d'exercices physiques. La plupart des personnes atteintes de PR devraient tirer profit de l'exercice physique. Cependant, la modalité d'exercice spécifique devrait être déterminée par les préférences et les valeurs du patient, en tenant compte de la charge potentielle et de la capacité de chaque patient. Les recommandations en matière d'exercice comprennent plusieurs types comme l’aérobie ou le renforcement musculaire. La fréquence, l'intensité et la durée de l'exercice n'ont pas été précisées dans les recommandations, compte tenu du fait que ces éléments devront être adaptés à chaque personne. Les recommandations américaines sur l'exercice et l'activité physique peuvent servir de guide aux cliniciens qui conseillent leurs patients. Les avantages de l'exercice et de l'activité physique vont au-delà de la prise en charge des symptômes de la PR, les données recueillies auprès de la population générale suggérant une amélioration de la longévité, une diminution du risque de développer des maladies chroniques surreprésentées dans la PR(par exemple, les maladies cardiovasculaires) et une amélioration de la santé mentale. Étant donné que les symptômes et les conséquences de la PR peuvent avoir un impact sur la participation, une prescription et un suivi plus personnalisés de l'exercice peuvent être nécessaires avec l'aide de kinésithérapeutes.
Diagnostics différentiels
Lors du diagnostic de la PR il est essentiel d’éliminer d’autres pathologie pouvant imiter la PR comme :
· Les rhumatismes microcristallins
· Les maladies infectieuses comme (viroses saisonnières, rhumatisme réactionnel aux infections intestinales ou urogénitales)
· Les maladies dégénératives (arthrose érosives)
Tout le contenu de cet article est présenté à titre informatif. Il ne remplace en aucun cas l’avis ou la visite d’un professionnel de santé.
Sources :
Radu, A. F., & Bungau, S. G. (2021). Management of Rheumatoid Arthritis: An Overview. Cells, 10(11), 2857. Article sous Creative Commons Attribution (CC BY) license
Lin, Y. J., Anzaghe, M., & Schülke, S. (2020). Update on the Pathomechanism, Diagnosis, and Treatment Options for Rheumatoid Arthritis. Cells, 9(4), 880. Article sous Creative Commons Attribution (CC BY) license
England, B. R., Smith, B. J., Baker, N. A., Barton, J. L., Oatis, C. A., Guyatt, G., Anandarajah, A., Carandang, K., Chan, K. K., Constien, D., Davidson, E., Dodge, C. V., Bemis-Dougherty, A., Everett, S., Fisher, N., Fraenkel, L., Goodman, S. M., Lewis, J., Menzies, V., Moreland, L. W., … Treadwell, J. R. (2023). 2022 American College of Rheumatology Guideline for Exercise, Rehabilitation, Diet, and Additional Integrative Interventions for Rheumatoid Arthritis. Arthritis & rheumatology (Hoboken, N.J.), 75(8), 1299–1311.